Un documento desclasificado por los tribunales demuestra que la vacuna Pfizer se lanzó realmente en… mayo de 2019, siete meses antes de la a...
Documentos desclasificados por los tribunales revelan sorpresas
El juez Mark T. Pittman (Tribunal de Apelación de Dallas, Texas) acaba de hacerlo de nuevo el 9 de mayo de 2023, al exigir la presentación de todos los datos relativos a la vacuna pediátrica de Pfizer y a la vacuna para adultos de Moderna , incluidos 4,8 millones de páginas, en virtud de 2 años vs los 23,5 solicitados por la FDA. En este caso, los laboratorios tienen hasta el 31 de junio de 2025 para cumplir.
La publicación de estos datos también estuvo marcada por una serie de informaciones sobre el origen del virus que los científicos estaban convencidos de que era el resultado de una investigación sobre ganancia de función financiada clandestinamente por el Dr. A. Fauci , ex director del Instituto Nacional de Alergia. e Infecciosas (NIAID) y exasesor médico de la Casa Blanca durante la pandemia de COVID-19. Hoy también sabemos que la fabricación de vacunas comenzó antes de la fecha oficial, según comunicó al público, después de que el director general de Moderna admitiera en una entrevista que su empresa ya había producido 100.000 dosis de la vacuna Covid-19 en 2019.
https://twitter.com/odrobsed/status/1632315917286752266?s=20
La divulgación de un acuerdo de confidencialidad muestra en realidad que " las posibles vacunas candidatas contra el coronavirus fueron transferidas de Moderna a la Universidad de Carolina del Norte el 12 de diciembre de 2019 , diecinueve días antes de que la Organización Mundial de la Salud (OMS) tuviera conocimiento de la aparición de los primeros casos. del SARS-CoV-2 en Wuhan ” ( The Expose ).
Un denunciante señala hoy nueva información, contenida en otro documento, también desclasificado tras una solicitud de la FOIA, que nos permite responder a esta pregunta, al menos técnicamente. El documento en cuestión es el informe de evaluación no clínica elaborado por el regulador australiano (Therapeutic Goods Administration – TGA). En la página 40 del informe se muestra que la empresa Acuitas formuló el ARNm que codifica la luciferasa transmitida por BioNTech y referenciada (RNA-EH190611-01c) en el informe R-20-0072, en tres tipos de nanopartículas: LNP12 (formulación DODMA:DOPE), LNP5 y LNP8.
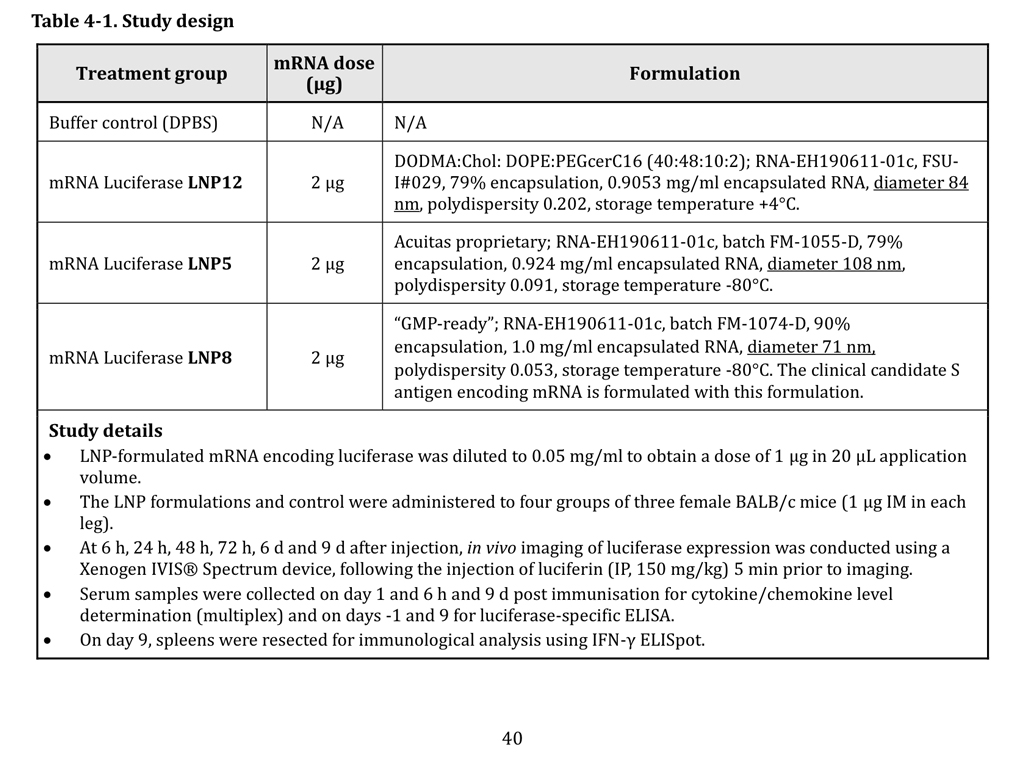
Sin embargo, la página 29 del informe de BioNTech muestra que la formulación de las nanopartículas destinadas a la vacuna (LNP8, como se menciona en la página 12 del mismo informe ) se llevó a cabo el 9 de diciembre de 2019, tres semanas antes de la divulgación del caso cero. en Wuhan . Siendo las indicaciones de formulación estrictamente idénticas entre los dos documentos, esta concordancia no deja lugar a dudas de que el certificado de análisis contenido en el informe de BioNTech se refiere a las nanopartículas utilizadas en el estudio australiano :
- Referencia del producto: RNA-EH190611-01c;
- Número de lote: FM-1074-D;
- Tasa de encapsulación: 90%;
- Concentración de ARN: 1,0 mg/ml;
- Diámetro: 71 nm;
- Rendimiento: 90%;
- Polidispersidad: 0,053:
- Temperatura de almacenamiento: – 80°C.

https://modarnlife.substack.com/p/the-pre-2020-bnt162-development-program
https://modarnlife.substack.com






Cuando compara las áreas resaltadas en azul, verde y morado en el TGA y las partes del estudio, puede ver varios errores en la versión del TGA: lote incorrecto de luciferasa y lípidos para DODMA: DOPE, lotes correctos de Luc/lípidos para LNP5/8 , ninguno. Las mediciones técnicas son las reportadas por Acuitas.
Inseguro de su significado, pero notable. Hipotéticamente, podría haber diferencias entre las técnicas/dispositivos/calibraciones de medición de Acuitas y BioNTech, o que el personal de TGA que redactó el informe confundiera certificados de análisis de diferentes estudios. Otras marcas son las siguientes: El cuadro azul muestra que las iniciales del experimentador están en el número de lote de lípidos de DODMA:DOPE, lo que refuerza la idea de que se trataba de un material que no era de Acuitas (al leer el estudio, lo dicen explícitamente, pero no importa). ), el cuadro rojo muestra que DODMA:DOPE fue el tercer artículo probado en R-20-0072 y de donde podría provenir el nombre TGA "LNPC12", el cuadro naranja es el segundo lote de luciferasa.
Curiosamente, el lote DODMA:DOPE utilizó FK190222, por lo que BioNTech debería haber incluido el correspondiente certificado de análisis de febrero en los apéndices. ¿Otros reguladores cometieron el mismo "error" al asignar el segundo lote de luciferasa al artículo de prueba DODMA:DOPE de R-20-0072, liberando así a BioNTech de tener que agregar un ARNm PO de febrero de 2019, un material de estudio bastante embarazoso? Mayo de 2019 ya es bastante malo; para ser honesto, probablemente sea solo un error. Probablemente.

Otro punto de incertidumbre fue el prefijo FK del primer lote, pero otros lotes de BioNTech (antes de cambiar su proceso de denominación interna para no reflejar la fecha de finalización) muestran la misma estructura: dos letras + seis números + caracteres superfluos. El segundo lote de luciferasa tiene "EH", el primer lote de BNT162b1 tiene "KG", etc.
Lo que sigue sin estar claro es el significado de "mod HA" frente a "mod Luc". El primero definitivamente codifica la luciferasa, como lo demuestran las imágenes de bioluminiscencia sin censura en el informe de la TGA.
Transponiendo los 16 días entre la fecha del pedido y la fecha indicada en el nombre del lote en el lote FK, se obtiene la fecha del pedido del 6 de febrero de 2019. Un año después, el jefe de Acuitas, Thomas Madden, estaría en Alemania para discutir BNT162- 01. ensayo clínico con BioNTech y el regulador alemán Paul-Ehrlich-Institut. A continuación se muestra un extracto de una entrevista de PharmaBoardroom de diciembre de 2020 :

Obviamente, BioNTech se había dado cuenta de esto mucho antes “cuando llegó la pandemia”, como lo demuestra la producción de ARNm de luciferasa pseudouridilada ya en febrero de 2019.
Mi impresión: los estudios piloto de formulación +R-20-0072 fueron una pieza clave. BioNTech había iniciado una colaboración con Pfizer para la vacuna contra la gripe en julio de 2018, una cobertura perfecta para comenzar el cambio del tratamiento personalizado del cáncer a las enfermedades infecciosas. Como lo demuestra el acuerdo del 17 de marzo de 2020 entre Pfizer y BioNTech, Pfizer desconocía la I+D de Acuitas. Esto se ve respaldado aún más por la primera mención de Acuitas en las presentaciones de BioNTech ante la SEC de 2021, donde BioNTech revela la licencia de la tecnología de Acuitas. ¿BioNTech estaba "desarrollando" una plataforma de vacunas contra enfermedades infecciosas con Acuitas en el fondo, gastando mucho dinero en esta tecnología cuando ya están asociados con la compañía farmacéutica más grande del mundo?
Digo “en desarrollo” por el momento favorable: el lote de luciferasa FK190222 data de febrero, el EH190611 data de junio, pero la primera entrega del producto a BioNTech tuvo lugar el 26 de noviembre. El siguiente albarán no llega hasta quince días después. Quince días durante los cuales BioNTech realiza el estudio piloto de formulación, evalúa los resultados y Acuitas formula los productos para el albarán del 11 de diciembre y el estudio R-20-0072.
Esto no es desarrollo, es una configuración programada en espera de ser implementada. La visita de la canciller alemana, Angela Merkel, a Wuhan en septiembre de 2019 ciertamente adquiere una luz completamente diferente.
Una cita del Anexo 1 de la filtración de la EMA:
El desarrollo de la formulación comenzó con la selección de nanopartículas lipídicas. Esto implicó incorporar los nuevos lípidos en LNP que encapsulan ARN y luego someterlos a un proceso de selección que incluye formulación piloto y caracterización física para determinar la idoneidad para las pruebas in vivo y la determinación de la actividad en un modelo de expresión de ARN en ratón.
Durante la formulación piloto, se formularon lípidos catiónicos candidatos con ARN que codifica luciferasa y otros componentes lipídicos en una composición estandarizada que incluye el lípido catiónico (ALC-0315, ALC-0218, etc.), un lípido PEGilado (ALC-0159), de DSPC. y colesterol. El uso de ARN que codifica la luciferasa permitió la evaluación visual de la expresión y traducción en sistemas modelo. Los resultados de estos estudios llevaron a la selección de ALC-0315.
Es simplemente aterrador lo descuidadas que están las fechas de estos estudios y desarrollos de investigación por parte de todas las agencias reguladoras.
Hay uno o dos estudios más en animales de luciferasa-LNP8 entre R-20-0072 y 38166 en el cronograma de desarrollo no clínico que involucran ratones knockout para ApoE, que se resumen en el Apéndice del medicamento.
Otro dato muy interesante de la filtración de la EMA (informe de calidad p56) es otra indicación sobre las diferencias entre BNT162b2v8 y v9: una nota a pie de página en un diagrama afirma que "RBP020.1 y RBP020.2 codifican el mismo antígeno, pero con variaciones". . Por lo tanto, en los codones utilizados difieren ligeramente en la secuencia de nucleótidos. La optimización de codones se realizó mediante un algoritmo patentado de BioNTech (RBP020.1) o con un algoritmo publicado (Raab et al. 2010; RBP020.2).

RBP020.1 es b2 v8, RBP020.2 es b2 v9, que terminó siendo Comirnaty. v9 provocó de 3 a 5 veces más anticuerpos que v8. BioNTech debe apestar si su optimización patentada de codones es completamente destruida por un programa de código abierto. Absolutas travesuras si lo piensas: explotaron su propia “incompetencia” para introducir un modRNA con codones bien optimizados en humanos sin un estudio toxicológico previo; 38166 utilizó BNT162b2v8, y el estudio de toxicidad de dosis repetidas para BNT162b2v9, 20256434 , comenzó el mismo día en que comenzó la dosificación de fase 3 de C4591001. ¿Optimizaron intencionalmente los codones de BNT162b2v8 de manera “incorrecta”, de modo que la secuencia óptima consensuada fuera mucho mejor y evitara la cola de ensayos en humanos?
Todavía no estoy del todo seguro sobre el patente triángulo amoroso de Genevant/Arbutus/Acuitas. ¿Quizás BioNTech probó las formulaciones de ALC a través de su colaboración con Genevant y decidió ir directamente a la fuente? Creo que es por eso que Vivek Ramaswamy los está persiguiendo. La colaboración contra la gripe de julio de 2018 con Pfizer parecía indicar que Pfizer podía sentir una ganancia inesperada inminente, pero BioNTech se aprovechó rápidamente de ellos y los obligó a negociar un nuevo acuerdo en marzo de 2020. Todo esto es puramente especulativo, por supuesto.
También está la cuestión de la transferencia de tecnología a Polymun y Dermapharm desde Acuitas, que se suponía que se completaría a tiempo para los anacrónicos Certificados de Análisis del 26 de marzo en 38166, pero que será tema de otro artículo.





